[왓슨 분자생물학] 19장 진핵세포의 전사조절-1
19.0 진핵세포의 전사조절
- 원핵 전사조절과의 차이는 이어맞추기 유전자 발현
- 가장 중요한 조절단계는 마찬가지로 전사 개시 단계
- 원핵보다 정교한 조절이 가능 : RNA pol II (+억제인자, 활성인자, 뉴클레오솜 구조를 바꾸는 인자, 조절서열, 조절단백질)
1. 뉴클레오솜 구조 변경 관련 인자
- 히스톤에 DNA가 감겨있어 조절단백질이 없으면 유전자발현 감소 → 뉴클레오솜 구조변화시, 발현조절 가능
- 히스톤을 재배열하거나 화학적 변화시키는 효소로 뉴클레오솜을 구조변화시켜 전사장치와 DNA 결합단백질의 결합력을 조절
- 전사인자나 RNA pol 은 뉴클레오솜의 이탈을 필요로 한다. 그래야 조절DNA와 상호작용 가능
- 인헨서처럼 광범위한 조절서열이 있고, 조절단백질 수가 많다 (프로모터와의 거리를 가깝게 한다.)
- 조절인자 결합자리의 수와 배열에 조절영향을 미친다,
2. 많은 조절단백질과 광범위한 조절서열
- 신호를 통해 유전자를 보다 정확한 시간·장소에서 작동시킨다.
- 원핵의 신호통합 : lac 오페론의 lactose, glucose, 단 2가지 조절단백질만 포함(cAMP,CAP)
- 효모 조절서열은 인헨서처럼 먼곳에서 조절하는 서열이 없다. 프로모터 부근에 수 십개의 조절인자 결합자리가 있다.
- 이 결합자리가 모여 인헨서단위를 이루는데 특정 인헨서는 유전자를 특정 시간과 특성 자리에서 활성화 시키는 조절인자와 결합한다.
- 다른 증폭자는 서로다른 조절인자와 결합하여 동일 유전자가 서로 다른 신호에 반응하여 다른 시간, 다른자리에서 발현되도록 조절
- 넓은 조절서열을 가진다는 것은 (진핵) 조절인자 결합자리가 조절유전자와의 거리가 멀다는 것
- 먼 곳에서 작용하기 위해 단백질 간 상호작용이 필요. DNA 가 고리형성
- 차단인자(Enhancer-blocker, insulator) : 인헨서 결합된 활성인자에 의해 프로모터가 무분별하게 활성화되는 것을 선택적으로 차단한다. 인헨서와 프로모터 사이에 결합.
3. 전사장치의 보존성
- 모든 진핵에서의 유전자조절의 기본방식은 동일 (세부적으로는 다르다)
- 진핵의 활성인자는 세균과 비슷. DNA 결합자리와 활성부위를 가지며 특정유전자에 단백질 복합체를 유인하여 전사 활성화한다.
- 반면에 억제인자는 세균가 다르다. 진핵은 유전자 침묵화를 포함한다.
- 유전자 침묵화 : 염색질·뉴클레오솜의 구조변화 → 넓은 DNA 부위 유전자를 구겨서 (짧은구간 억제) 서열특이적억제자가 증폭자 내의 인접부위에 결합하여 활성억제
① 단백질에 조절되는 전사, ② RNA에 조절되는 전사로 구분

19.1 보존된 전사조절 기작
1. 활성인자는 DNA-결합 및 활성화 가능
- CAP 같은 활성인자는 DNA 결합·활성화 기능을 별도로 가진다. (진핵세포도 별도로 다른부위에 가진다.)
- 효모 활성인자 Gal4 : lactose 분해 유전자 활성화. GAL1 유전자 전사를 1000배 활성화 (GAL1 상류의 UASG에 결합시)
- 활성인자의 DNA 결합영역과 활성화영역은 서로 격리되어 있다.


2. 진핵세포의 조절인자 (원핵과 결합단백질이 결합자리를 인지하는 원리와 똑같다)
- α나선구조를 DNA 큰홈에 결합하는 것이 기본. 결합부위의 DNA 가장자리 염기쌍 감지
- 세균의 조절단백질은 나선-회전-나선 모티프 사용 (인지 나선-DNA골격 결합나선) 강력결합 (진핵도 동일)
1) 호메오 도메인 단백질
- 나선-회전-나선 DNA 영역의 한 부류. DNA 결합부위를 인지하는 단백질 (큰홈)
- 모든 진핵에 존재. 구조적으로 유사. 그러나 상세한 세부구조는 매우 다양

2) 아연 함유 DNA 결합영역 (Zn)
- 아연을 가지는 DNA 결합영역 (+Zn 집게 단백질)
- Zn은 시스테인·히스티딘과 상호작용 → DNA 결합영역의 고유성질에 필요한 구조적 역할 제공
- 여기도 DNA는 α나선을 큰홈에 삽입하는 방식으로 인지 (아연함유 DNA결합영역을 가진 활성인자의 α나선)
- 아연집게 도메인 : 아연은 α나선의 2개 히스티딘 잔기와 β병풍의 2개 시스테인 잔기에 공유. 이 배열은 단백질 구조 안정화, DNA 결합에 필수적
- 아연집게를 가진 단백질의 각 finger는 1개씩 α나선을 큰홈에 삽입 (인지되는 DNA가 길어짐. 결합강도 증가)
- 아연사용 DNA 결합영역에서 아연은 4개 시스테인잔기와 연합하여 DNA 인지 모티프 안정화
- 빨래집게처럼 2개 이상의 아연집게로 DNA를 잘 펴줌
3) 루신 지퍼 모티프
- 단일 구조 내에서 2량체화와 DNA 결합표면을 모두 가진다. α나선이 집게구조 형성. 큰홈삽입
- 루신지퍼를 가진 단백질은 이종2량체나 동종2량체 형성

4) 나선-고리-나선 단백질 (HLH)
- 루신지퍼처럼 두 단량체로부터 확장 α나선 부위가 큰홈에 삽입
- 긴 α나선이 ① DNA 인지 ② 짧은 α나선과 2량체 형성 관여
- 루신지퍼와 HLH 단백질은 염기성지퍼, 염기성 HLH단백질이라고도 한다. (DNA 음전하와 결합하기 위해 α나선부위가 염기성아미노산잔기가 있음)

5) HMG 단백질 (작은홈 결합. DNA 나선형태까지 변화시킴)
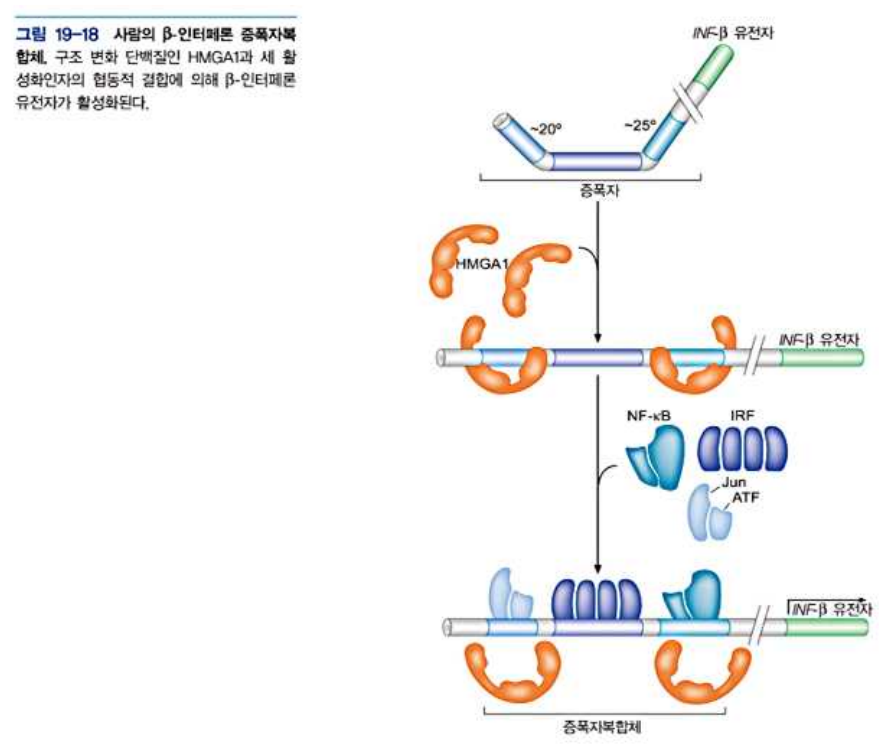
- HMG 단백질은 AT 갈고리 (고도로 보존된 펩티드 모티프를 가짐) 로 작은홈과 결합하여 DNA 나선형태 변화
- 이 방식으로 고차원의 단백질-DNA복합체 형성을 쉽게 해줌 → 인터페론 증폭과 복합체 형성에 관여 (다른 활성인자가 DNA에 결합하도록 돕고, HMG는 다시 떨어진다)
- 발생에도 중요한 역할을 한다. (ex. HMG를 가지는 sox 조절자 : 배아줄기세포의 전능성에 필수적인 유전자)
- LEF-1(인헨서 결합 단백질) · TBP (보편전사인자. TATA 결합단백질) : DNA 표적부위를 작은홈에 두고 서열특이성을 유연하게 전달
3. 활성화 부위의 구조 (아직 밝혀지지 않음)
- 구성 아미노산에 따라 분류 (산성, 염기성)
- 활성화 부위는 약한 활성능력을 가진 작은 소단위로 구성된다
- 각각의 단위는 짧은 아미노산 서열. 이 단위가 많아질 수록 활성 부위가 강해진다.
- 활성화 부위는 고정된 구조가 아닌 유연한 접착성 표면으로 작용
참고문헌 : Watson. (2014). 왓슨 분자생물학(7판). (주)바이오사이언스출판
